8 月 20 日,艾伯维(ABBV.US)和 Genmab(GMAB.US)共同宣布了一则重大消息,欧盟委员会已经批准 Tepkinly(epcoritamab)扩展适应症,用于治疗复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者,这些患者先前接受过 2 线以上的系统性疗法。
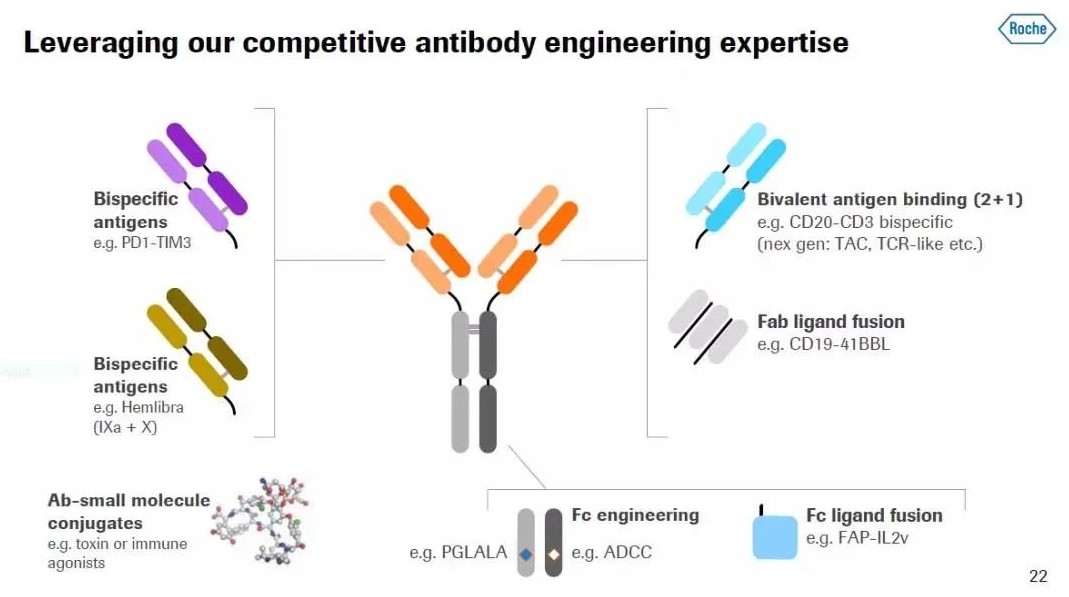
Tepkinly 是一款皮下给药的创新药物,基于 Genmab 公司专有的 DuoBody 技术构建的 IgG1 亚型双特异性抗体。Genmab 的 DuoBody-CD3 技术旨在选择性地引导细胞毒性 T 细胞向靶细胞类型产生免疫反应。它同时结合 T 细胞上的 CD3 和 B 细胞上的 CD20,并诱导 T 细胞介导的 CD20 阳性细胞的杀伤。
值得一提的是,Tepkinly 是欧盟批准用于治疗 R/RFL 和 R/R 弥漫性大 B 细胞淋巴瘤(DLBCL)的首款皮下注射 T 细胞接合双特异性抗体。这款创新疗法也被行业媒体 Evaluate 列为 2023 年的十大潜在重磅疗法之一。
据悉,这次批准主要是基于 EPCORENHL-1 临床 1/2 期试验的结果,该试验评估 Tepkinly 在 127 名 R/RFL 患者中的疗效与安全性。分析显示,患者的总缓解率(ORR)达 83%,完全缓解率(CR)为 63%。在中位随访时间为 16.2 个月时,中位缓解持续时间(DoR)为 21.4 个月。这些结果最近发表在《柳叶刀》子刊 Lancet Haematology 当中。
Tepkinly 在去年 5 月首次获得美国 FDA 的批准(商品名 Epkinly),用于治疗 R/RDLBCL。此次在欧盟获批扩展适应症,无疑为更多患者带来了新的希望。这一成果不仅彰显了医药研发领域的不断突破,也为全球医疗事业的发展注入了新的动力。
相信在未来,随着医学研究的不断深入和技术的持续创新,会有更多高效、安全的治疗方案问世,为广大患者带来福音。